近日,北京生命科學研究所/清華大學生物醫學交叉研究院韓霆實驗室與黃牛實驗室在《細胞》(Cell)上在線發表了題為“用TRIM21基分子膠和PROTAC降解劑選擇性降解多聚蛋白”(Selective degradation of multimeric proteins by TRIM21-based molecular glue and PROTAC degraders)的研究論文。該研究發現乙酰丙嗪的代謝產物(S)-ACE-OH具有E3泛素連接酶TRIM21介導的分子膠活性,并據此設計了基于TRIM21的新型PROTAC分子(命名為TrimTAC),能夠選擇性降解多聚蛋白而不影響單體蛋白。由于異常蛋白聚集會引發自身免疫疾病、神經退行性疾病以及癌癥,上述研究成果突顯出TrimTAC技術的應用前景。
研究人員首先通過基于表型的高通量篩選發現了乙酰丙嗪(ACE)能與干擾素協同殺傷非小細胞肺癌細胞系A549。使用乙酰丙嗪處理多種腫瘤細胞系和正常細胞,發現乙酰丙嗪對部分腫瘤細胞系選擇性殺傷,但不影響另一些腫瘤細胞系以及正常細胞。進一步研究發現,ACE敏感細胞系通過醛酮還原酶將ACE還原成了S構型的羥乙基丙嗪(ACE-OH),而(S)-ACE-OH是殺傷腫瘤細胞的ACE代謝產物。
為了探究(S)-ACE-OH如何殺傷腫瘤細胞,研究人員進行了全基因組CRISPR篩選,發現TRIM21是介導(S)-ACE-OH殺傷腫瘤細胞的關鍵因子。通過基因敲除和過表達實驗證明了TRIM21的表達量與(S)-ACE-OH的細胞毒性成正相關;而TRIM21的表達則受到干擾素的誘導。上述發現為ACE和干擾素的協同殺傷腫瘤細胞的活性提供了合理的解釋。
TRIM21是一種先天免疫受體,可識別逃逸到細胞質內并且被抗體包被的病毒,從而觸發抗病毒免疫反應。TRIM21的C端PRYSPRY結構域具有一個疏水口袋,可結合抗體的Fc區。研究人員在TRIM21的Fc結合口袋中構建了幾個點突變,發現W381A或W383A突變完全阻斷了乙酰丙嗪的活性,而D355A突變則增強了乙酰丙嗪的敏感性,上述結果表明TRIM21與Fc結合的口袋很可能也是(S)-ACE-OH結合的位點。
由于TRIM21具有E3泛素連接酶活性,研究人員通過定量質譜實驗發現(S)-ACE-OH可以誘導NUP35、SMPD4和GLE1等多個核孔蛋白的降解,從而破壞了核孔結構,造成核質主動轉運功能的喪失。為了探究核孔復合物上TRIM21直接的作用靶點,研究人員進行了CRISPR-suppressor scanning和PML-degron融合蛋白降解實驗,將核孔復合物上的靶點錨定到了NUP98。研究人員進一步使用GST pulldown和ITC實驗在體外重構了(S)-ACE-OH、TRIM21和NUP98的三元復合物,從而證明(S)-ACE-OH是一種全新的分子膠。
研究人員通過X射線晶體衍射獲得了乙酰丙嗪及其代謝產物與TRIM21的共晶結構,為新配體的開發和PROTAC的設計提供了方向。根據晶體結構設計了基于TRIM21的PROTAC(命名為TrimTAC)。通過對比TrimTAC和傳統的基于CRBN的PROTAC的細胞活性,發現TrimTAC不能降解單體蛋白,但能降解聚集形式的蛋白;而基于CRBN的PROTAC不具備上述選擇性。這一特性來源于TRIM21的本身性質:與多聚的靶蛋白結合后,TRIM21的RING結構域二聚,才能激活其E3泛素連接酶的活性。為了驗證TrimTAC在疾病治療方面的應用前景,研究人員使用TrimTAC實現了胞質DNA誘導的cGAS聚集體的選擇性降解,從而為TrimTAC治療自身免疫性疾病提供了潛在應用場景。
綜上所述,研究發現乙酰丙嗪的代謝產物(S)-ACE-OH具有分子膠活性,誘導E3泛素連接酶TRIM21與核孔蛋白NUP98相互作用,從而引發核孔蛋白的降解。基于乙酰丙嗪衍生的TrimTAC分子可以實現對多聚致病蛋白的選擇性降解,而不影響單體蛋白。由于蛋白質異常聚集可導致自身免疫疾病、神經退行性疾病及癌癥等多種疾病,研究展示了多聚體選擇性的TrimTAC技術的廣闊應用前景。
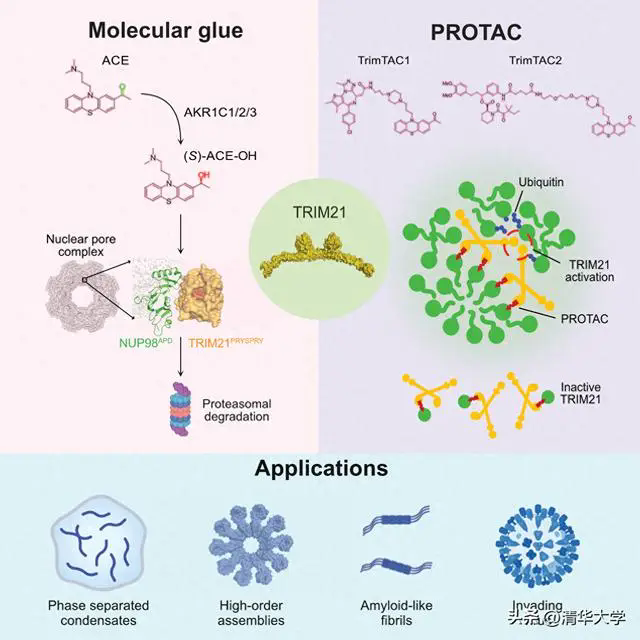
基于TRIM21的分子膠和PROTAC的作用機理以及未來的應用方向
北京生命科學研究所/清華大學生物醫學交叉研究院韓霆研究員與黃牛研究員為論文的共同通訊作者。韓霆實驗室2019級博士生陸盼睿、2021級博士生程亞龍、2020級博士生薛雷和黃牛實驗室2022級博士生任欣桐為論文共同第一作者。高通量篩選得到了化學中心/齊湘兵實驗室的大力支持,李超實驗室的陳成龍也對該研究作出了重要貢獻。研究得到北京市科委、清華大學生物醫學交叉研究院以及北京生命科學研究所的資助。